
一种基于微流控的仿生方法,用于制造体外3D肝小叶样微组织。
Introduction
肝组织工程在过去的几十年里一直吸引着科学界、制药界和临床界的广泛关注,因为它有可能为肝功能衰竭的患者提供功能支持/替代,或者为研究肝细胞功能、肝病以及药物代谢和毒性提供体外组织模型。传统的肝组织工程技术主要采用“自上而下”的策略,其中肝细胞被接种在一个预成型的聚合物支架上,在生理线索的帮助下定植于支架上,并生成合适的细胞外基质(ECM)和形态结构。
尽管通过研究更具有仿生性的框架(如去细胞的ECM支架)取得了重要进展,自上而下的方法通常难以复制复杂的肝组织微结构特征。与之相比,自下而上的方法被提出以改善工程组织中的细胞控制,通过合并简化的构件来制造分层的组织。
这种情况下,一种预先构建的、类似于肝小叶(一种由肝细胞索和肝血窦状放射状排列形成的精心安排的肝单位)的肝组织构件是非常可取的。此前已经有工作使肝细胞形成线性排列的肝索样结构,一般来说,这些体外肝细胞培养系统或可用于研究毒性的具体方面。然而,这些系统未能组织异质细胞类型,以模仿高级的肝脏架构(即肝血窦),可以保留细胞-细胞和细胞-ECM的相互作用。
本研究提出了一个微流控仿生方法用于在体外制造3D肝小叶样微组织,该组织由放射状图案化的肝索状网络和内在的肝血窦状网络组成。功能表征显示该3D仿生肝小叶样微组织在相I/II阶段保持了更高的基础肝特异性功能(也就是CYP-1A1/2和UGT活性)
Figure 1. Biomimetic construction of a 3D liver lobule-like microtissue
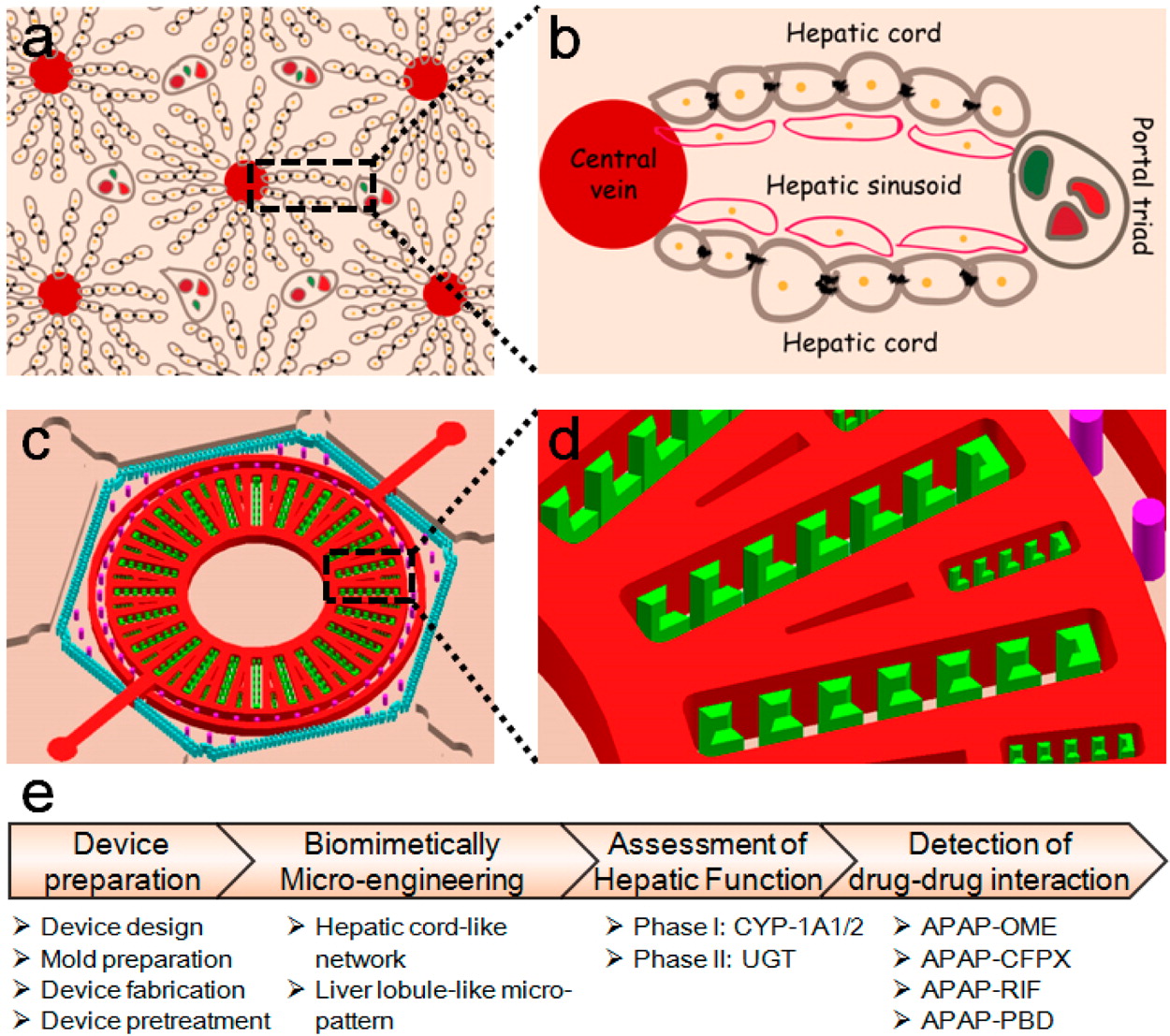
- (a)肝脏结构的示意图。
- (b)肝血窦由肝细胞和内皮细胞组成,呈索状排列,相当于(a)中的区域。
- (c)仿生微流控装置的三维布局。该装置有一个六边形的细胞培养室,其中有一个放射状的微图案柱阵列和一个气动的微阀系统(PμS,用红色标示)。
- (d)放大图像显示了装置的设计细节,相当于(c)中的区域。
- (e)3D仿生微组织的微工程构建、功能评价和药理应用实验流程。
Figure 2. Schematic diagram illustrating the sequential procedure for constructing the biomimetic microtissue
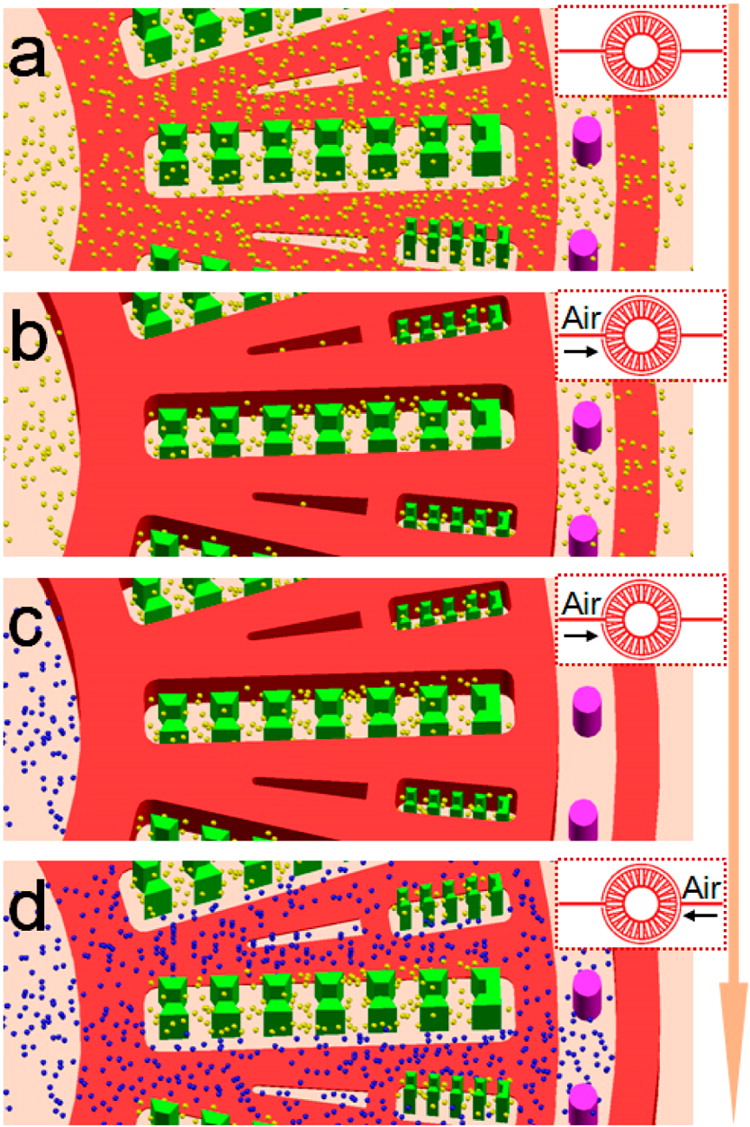
- (a)将HepG2细胞(黄色粒子)和胶原的冰冷混合物轻柔地引入腔室。
- (b)通过微阀系统形成肝索样网络。
- (c)HAECs(蓝色粒子)添加入入口。
- (d)通过内阀的关闭被动流入预形成的凝胶通道,被外阀所阻挡。
Figure 3. Morphological demonstration of the 3D liver lobule-like microtissue
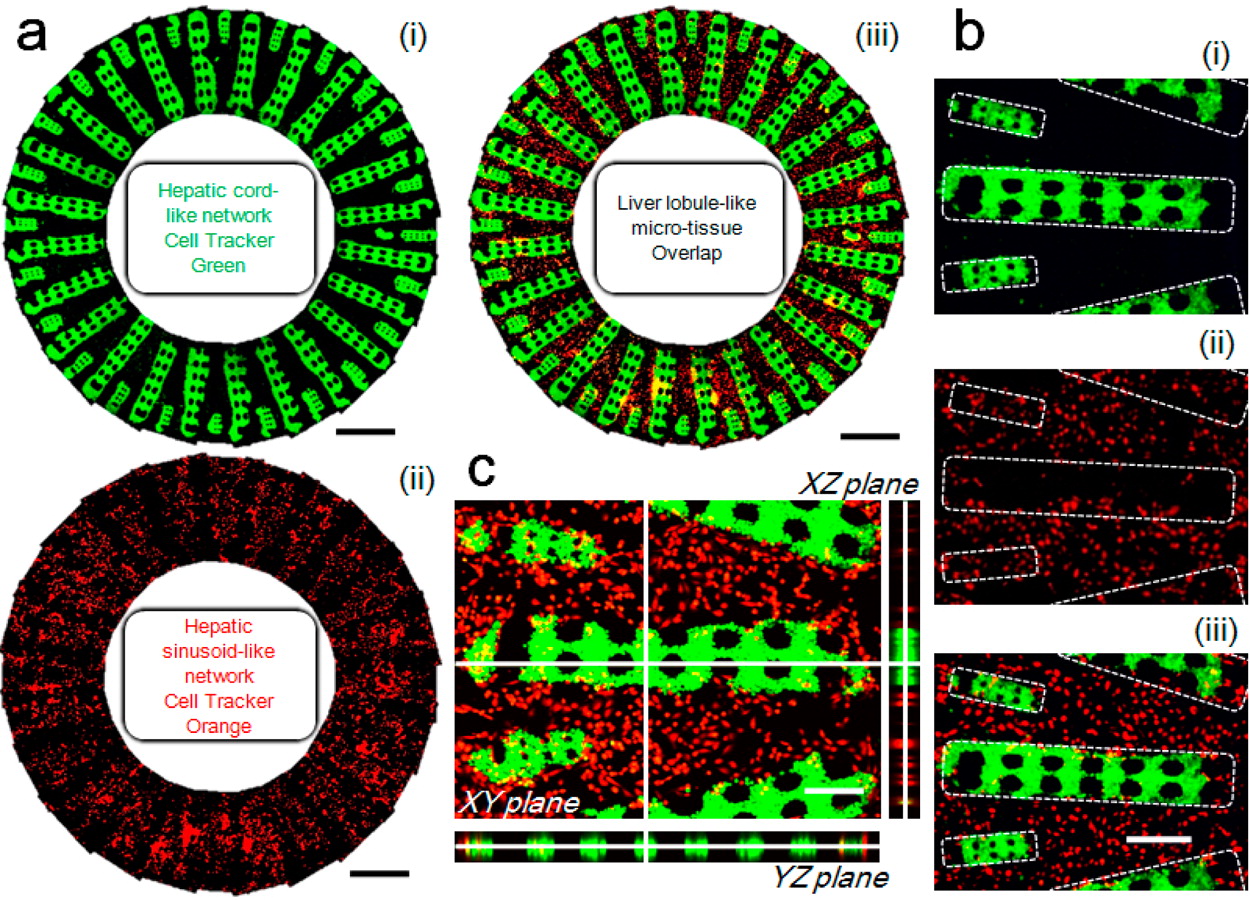
- (a)制造的肝小叶样微组织由肝索样网络(i)和肝血窦样网络(ii)组成。(i)和(ii)分别由24张图像利用图像处理软件合成。(iii)为(i)和(ii)的重叠图。
- (b)单个肝血窦样结构的放大图,其中HAECs与HepG2细胞形成的相应的肝索排成一排。
- (c)肝血窦样结构的三维视图。
Figure 4. Hepatic enzyme activity of the biomimetic microtissue
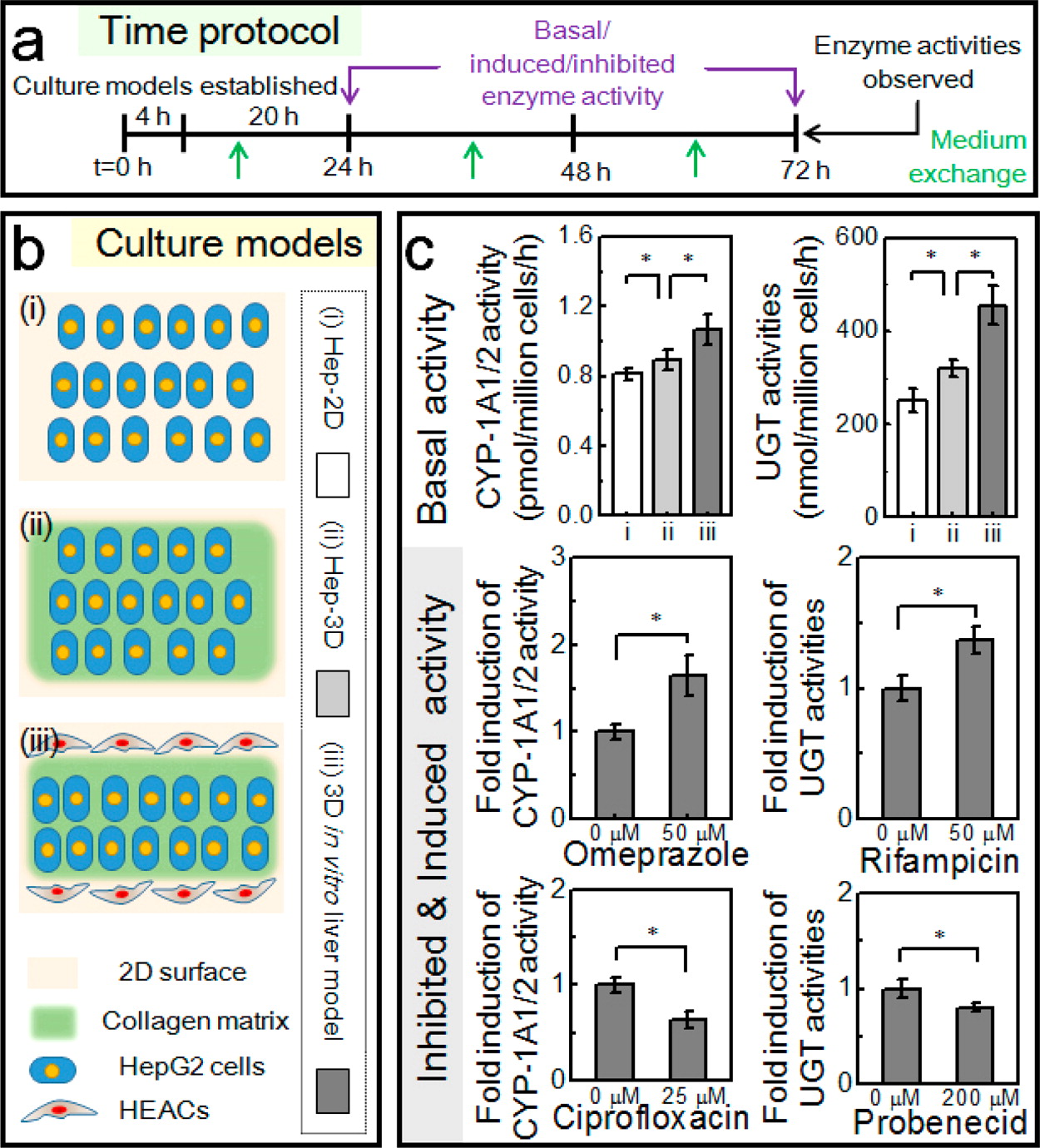
- (a)酶活性检测实验的时间流程。对经过 72 h 培养后三种培养模型分别给予不同药物的不同剂量24 h处理。药物处理后,测定酶活性。
- (b)为更好地表征肝小叶样肝脏芯片的酶活力,实验中定义和构建了三种 HepG2 细胞培养模型,即 Hep-2D 模型、Hep-3D 模型和肝小叶样肝脏芯片模型。
- (c)CYP-1A1/2和UGT活性。结果显示,肝小叶样微组织比Hep-3D培养模型保持较高的基础酶活性,而后者又高于 Hep-2D 培养模型。经过诱导剂(如奥美拉唑(OME)和利福平(RIF))或抑制剂(环丙沙星(CPFX)和丙磺舒(PBD))处理后,肝小叶样肝脏芯片的 CYP-1A1/2 和 UGT 酶活力表现出显著增加或减少。
Figure 5. Drug sensitivity of the biomimetic microtissue
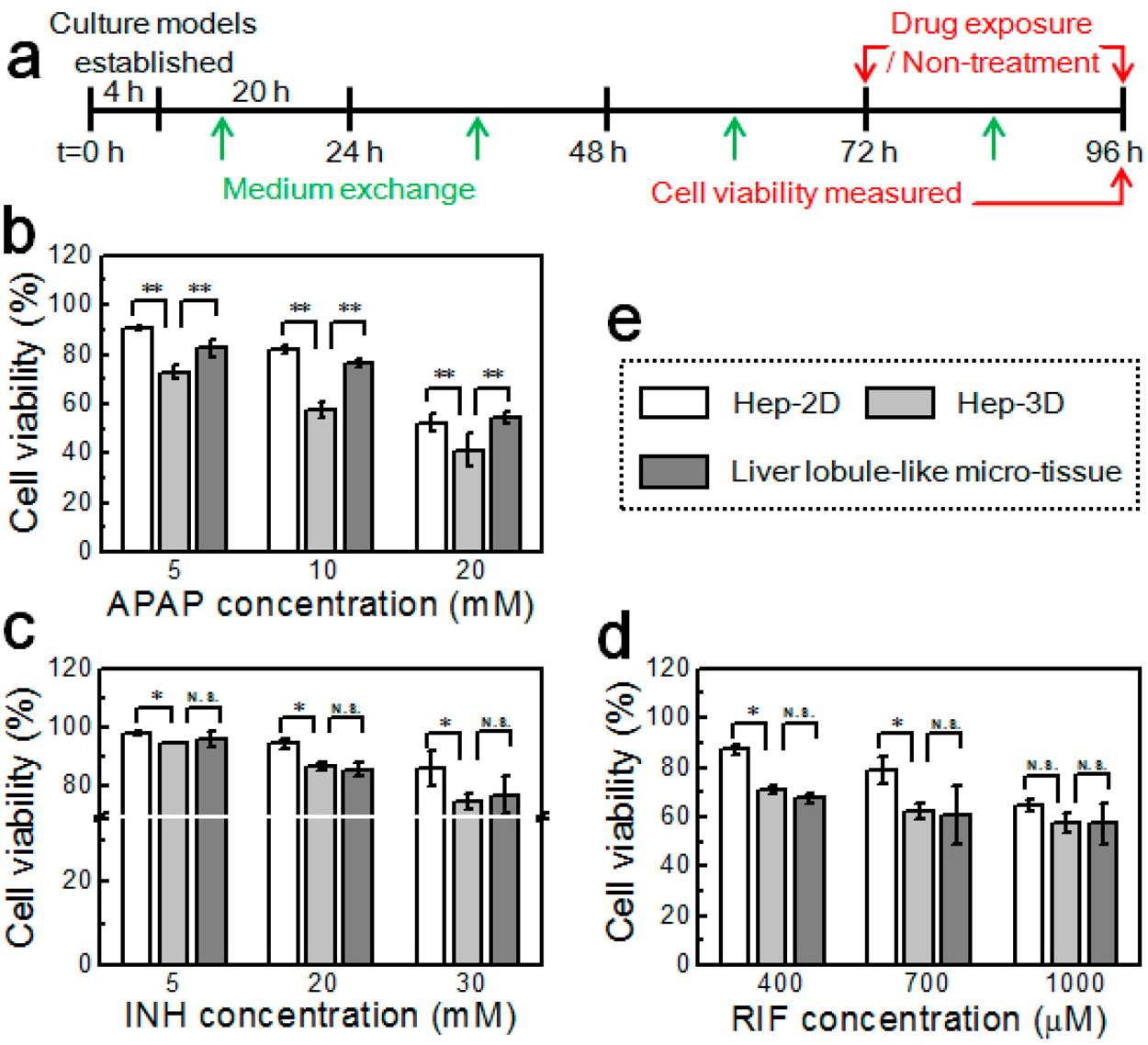
- (a)药物敏感性分析实验的时间流程。
- (b)APAP诱导的急性肝毒性。
- (c)INH诱导的急性肝毒性。
- (d)RIF诱导的急性肝毒性。
- (e)三种培养组。
MTT试验原理是活细胞线粒体中的琥珀酸脱氢酶NADPH还原四甲基偶氮唑蓝MTT生成紫色结晶沉淀-甲瓒化合物,而死细胞无此功能。
FDA,中文名为二乙酸荧光素,是一种具细胞膜渗透性的酯酶底物,常用作细胞活力分析。不仅可以测定酯酶活力,因FDA需要在酯酶的催化下才能活化产生绿色荧光;而且还可用来鉴定细胞膜完整性,只有在完整膜内才能维持荧光。也可用于流式分析。最大激发波长(Ex)和发射波长(Em)分别为490nm和526nm。
Figure 6. Detection of drug–drug interactions via the biomimetic microtissue
APAP,作为经典肝毒性药物模型,被选为目标测试药物。一般情况下,即使用正常剂量时,约 90%的APAP经相II肝代谢酶(UGT)等转化为无毒的化合物,并排泄到胆汁或尿液中。余下的约 5~9%的APAP由相I肝代谢酶,即细胞色素P450酶(CYP-1A1/2),代谢生成N-乙酰基-对苯醌亚胺(NAPQI)。NAPQI可以与细胞内的谷胱甘肽结合,被有效地解毒。然而,如果过量服用 APAP,肝细胞内将代谢产生过量的NAPQI,这些NAPQI不仅会耗尽细胞内的谷胱甘肽,而且与细胞内蛋白共价结合、诱导的氧化应激,最终导致肝损伤。
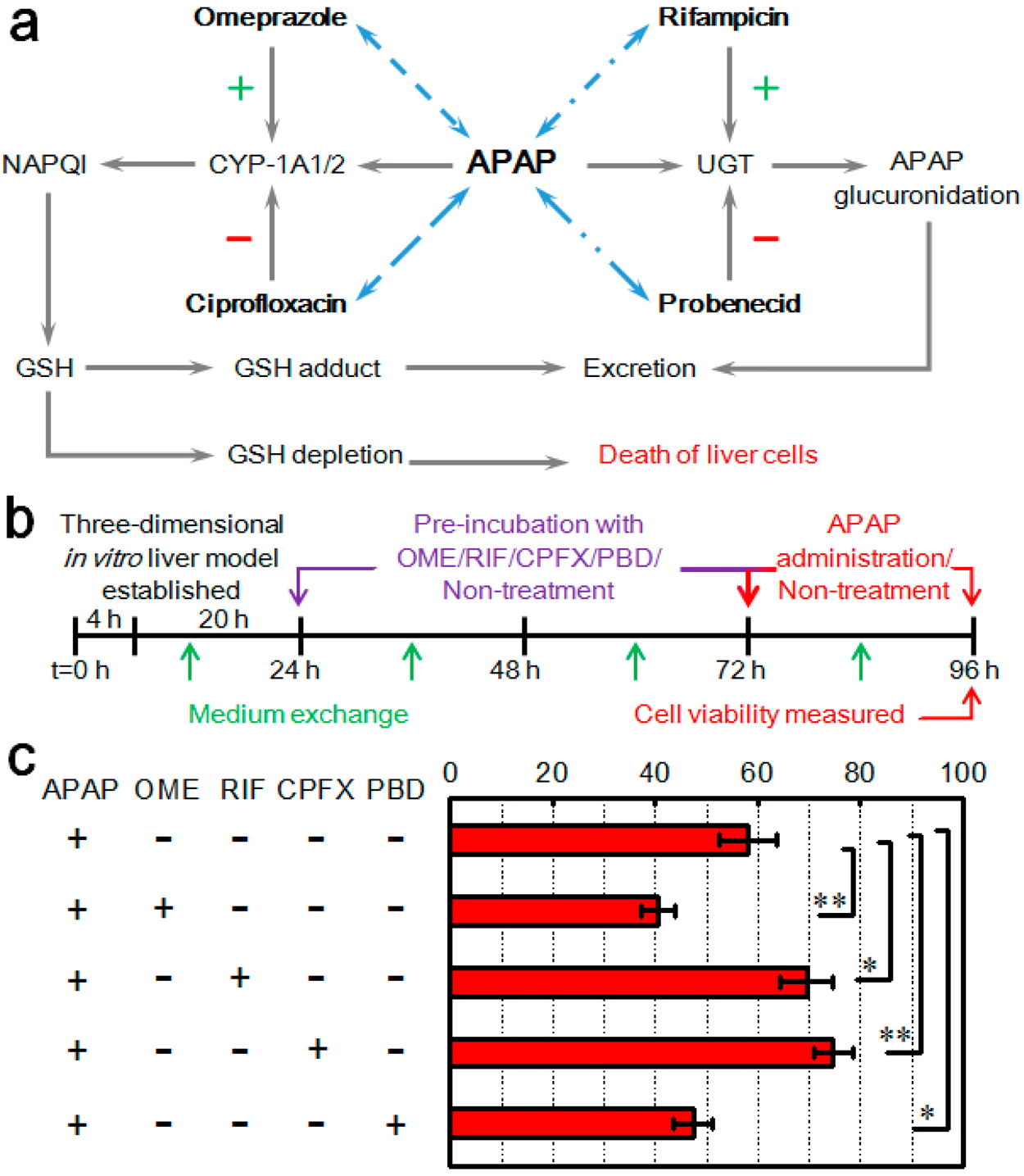
- (a) APAP 的肝脏代谢途径和不同药物的潜在影响。
- (b)药物相互作用检测试验的时间流程。
- (c)由此产生的肝细胞活性。
APAP-OME药物组合处理增加了HepG2细胞的死亡率,而APAP-CFPX药物组合处理提高了细胞的存活率。同样,RIF预处理减轻了APAP诱导的肝毒性,而PBD预处理加剧了APAP的肝毒性作用。结果表明,肝小叶样肝脏芯片可以于体外再现CYP-1A1/2或UGT介导的药物间相互作用。这些结果证实了肝小叶样肝脏芯片可以作为一个可靠、有用的组织模型用于潜在的药物不良反应分析研究。
Conclusion
- 开发了一种基于微流控的仿生肝小叶样微组织。利用气阀可以在微尺度分辨率下以3D方式操纵不同的细胞类型,即肝细胞(HepG2细胞)和非实质细胞(HAECs)。
- 代谢活力试验表明,肝小叶样微组织比2D培养具有更好的CYP-1A1/2和UGT酶活力,同时也可以应答与这两类酶的特定诱导剂和抑制剂。
- 肝毒性试验表明,肝小叶样微组织比2D培养状态下更敏感,可以有效响应不同药物的肝毒性。
- 药物相互作用分析试验表明,肝小叶样微组织于体外再现了CYP-1A1/2或UGT介导的药物间相互作用,证实了其可以作为一个可靠、有用的组织模型用于潜在的药物不良反应分析研究。
Reference
Ma C, Zhao L, Zhou E-M, et al. On-Chip Construction of Liver Lobule-like Microtissue and Its Application for Adverse Drug Reaction Assay[J]. Analytical Chemistry, 2016, 88(3): 1719–1727.




